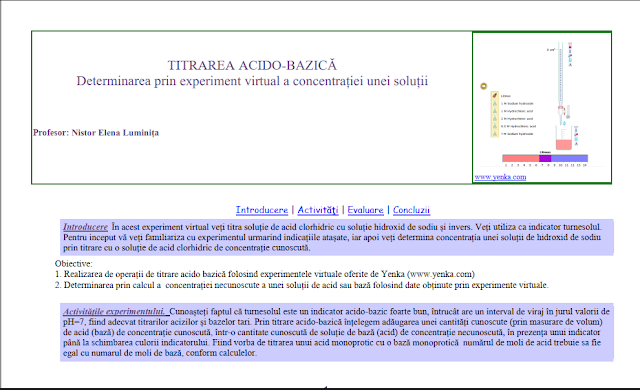
Probă de evaluare
la unitatea de învățare Legături chimice,
clasa a 9-a
Varianta1.
I.Se dau urmatoarele perechi deatomi:
H şi Cl; Mg şi S;
C şi H.
a.
Alegeti perechea care formeaza legatura ionică. Justificaţi rãspunsul.
b.
Modelaţi formarea legãturii ionice folosind puncte în locul electronilor de
valență.
c.
Notați patru proprietăți fizice ale substanței ionice.
d.
Alegeți perechea/perechile care formează legatura covalentă. Justificaţi
rãspunsul.
e.
Modelaţi formarea legãturii ionice folosind puncte în locul electronilor de
valență.
II. Se considera urmatorul șir de substanțe: NaCl, Ag, CO2,
ZnO, SiO2, CCl4, HNO3, P4, H2O,
NH3, Fe, Fe2O3,
Asezați fiecare substanță în coloana potrivită.
|
Legături
ionice |
Legături
covalente polare |
Legături
covalente nepolare |
Legături
metalice |
|
|
|
|
|
III. Asezați substanțele din lista de mai jos
în coloanele potrivite: CO2,
CCl4, HONO2, P4, H2O, NH3,
H2S, H2, Ar, He.
|
Legături
de hidrogen |
Legături
dipol-dipol |
Forțe
de dispersie |
|
|
|
|
Atentie,
între moleculele unei substanțe se pot stabili mai multe tipuri de interacțiuni!
IV.Indicați
toate tipurile de legături chimice care
se stabilesc în compusul: [Co(H2O)6](OH)3, arătând
și între ce atomi sau grupe de atomi se formează. Scrieți cine este acceptorul
și care sunt donorii, în cazul în care apreciați că există și legături
coordinative.
Probă de evaluare
la unitatea de învățare Legături chimice, clasa a 9-a
Varianta 2.
I.Se dau urmatoarele perechi de atomi:
H şi O; S şi Ca;
N şi H.
a.
Alegeti perechea care formeaza
legatura ionică. Justificaţi rãspunsul.
b.
Modelaţi formarea legãturii ionice folosind puncte în locul electronilor de
valență.
c.
Notați patru proprietăți fizice ale substanței ionice.
d.
Alegeți perechea/perechile care formează legatura covalentă. Justificaţi
rãspunsul.
e.
Modelaţi formarea legãturii ionice folosind puncte în locul electronilor de
valență.
II. Se considera urmatorul sir de substante: NaBr, Ca, CO,
LiOH, SiO2, CH4, HNO2, S4, H2O,
PH3, Zn, Fe3O4.
Asezați fiecare substanță în coloana potrivită.
|
Legături
ionice |
Legături
covalente polare |
Legături
covalente nepolare |
Legături
metalice |
|
|
|
|
|
III.Așezati
substanțele din lista de mai jos în coloanele potrivite: CO, CH4,
HONO, S8,HF, NH3, H2O, H2, Ar, N2.
|
Legături
de hidrogen |
Legături
dipol-dipol |
Forțe
de dispersie |
|
|
|
|
Atentie,
între moleculele unei substanțe se pot stabili mai multe tipuri de interacțiuni
!
IV.Indicați
toate tipurile de legături chimice care
se stabilesc în compusul: [Cr(NH3)6](OH)3,
arătând și între ce atomi sau grupe de atomi se formează. Scrieți cine este
acceptorul și care sunt donorii, în cazul în care apreciați că există și legături
coordinative.
Profesor
Nistor Elena Luminița